ادارة الاغذية والعقاقير والاتحاد الأوروبي توسيع اتفاقية الاعتراف المتبادل ، مرة أخرى!

في 31 مايو 2023 ، أعلنت إدارة الغذاء والدواء الأمريكية (FDA) والاتحاد الأوروبي (EU) عن توسيع الملحق القطاعي لاتفاقية الاعتراف المتبادل بين الولايات المتحدة والاتحاد الأوروبي (MRA) لممارسات التصنيع الجيد للأدوية (GMP). ويشمل هذا التوسع الآن عمليات تفتيش على المستحضرات الصيدلانية البيطرية، والمعروفة أيضا باسم "الأدوية الحيوانية".
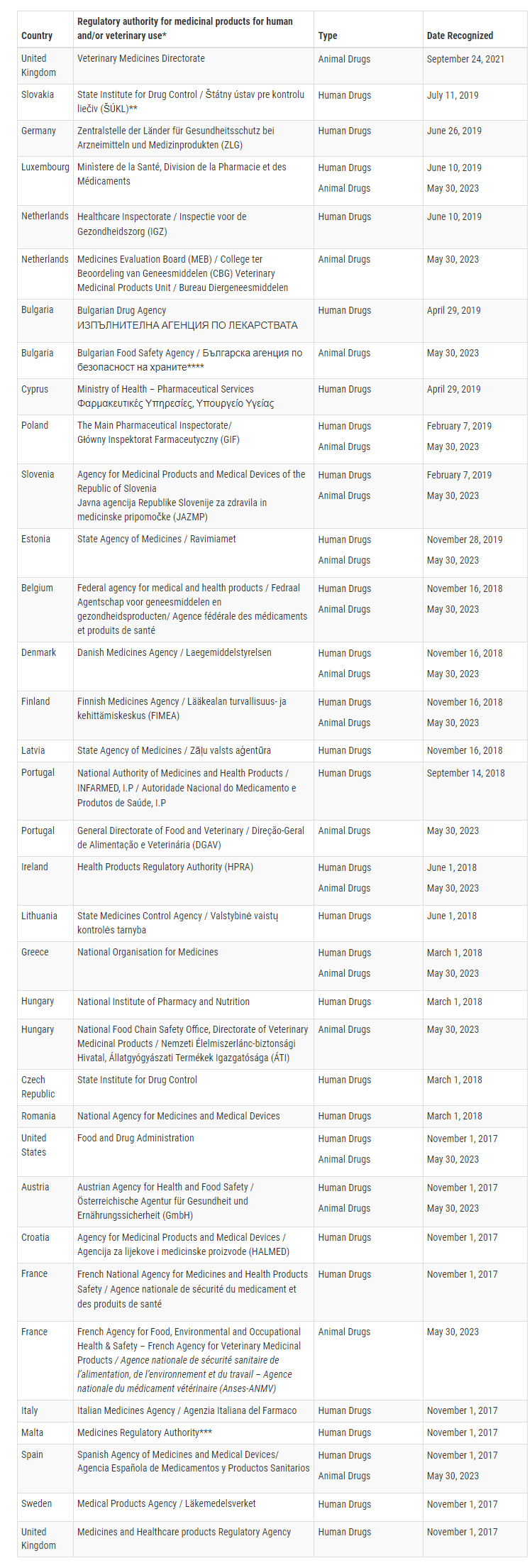
حاليا ، أكدت إدارة الغذاء والدواء الأمريكية أن 16 دولة عضو في الاتحاد الأوروبي قادرة على إجراء عمليات تفتيش GMP لمنتجات بيطرية محددة بمستوى يعادل الولايات المتحدة. وهذه الدول الأعضاء هي إسبانيا، وإستونيا، والبرتغال، وبلجيكا، وبلغاريا، والدانمرك، وسلوفينيا، وفرنسا، وفنلندا، ولكسمبرغ، والنمسا، وهنغاريا، وهولندا، واليونان، وهنغاريا.
مع هذا MRA الموسع ، يمكن لإدارة الغذاء والدواء الاعتماد على عمليات التفتيش GMP التي تجريها هذه الدول الأعضاء ال 16 لمرافق المنتجات البيطرية ، في حين سيعتمد الاتحاد الأوروبي على عمليات التفتيش التي تجريها إدارة الغذاء والدواء. يعزز هذا الاعتراف المتبادل التعاون التنظيمي ويبسط الإشراف على الأدوية البيطرية بين إدارة الغذاء والدواء والاتحاد الأوروبي.
ما هو MRA؟
تسهل اتفاقيات الاعتراف المتبادل (MRAs) التعاون بين إدارة الغذاء والدواء والسلطات التنظيمية الأجنبية ، مما يسمح لمفتشي الأدوية بالاعتماد على معلومات التفتيش التي يتم إجراؤها في الولايات القضائية لبعضهم البعض. يمنح قانون السلامة والابتكار في إدارة الغذاء والدواء ، الذي تم تنفيذه في عام 2012 ، إدارة الغذاء والدواء سلطة إبرام اتفاقيات تعترف بعمليات التفتيش على الأدوية التي تجريها السلطات التنظيمية الأجنبية التي تلبي متطلبات الولايات المتحدة.
تخدم اتفاقيات الاعتراف المتبادل غرضين رئيسيين:
1. تعزيز الكفاءات: من خلال تجنب عمليات التفتيش المزدوجة، تعزز اتفاقيات الاعتراف المتبادل العمليات المبسطة لكل من الأنظمة التنظيمية الأمريكية والأجنبية.
2. تخصيص الموارد: تمكن اتفاقات الاعتراف المتبادل من إعادة تخصيص الموارد للتركيز على تفتيش مرافق تصنيع الأدوية التي يحتمل أن تكون مخاطر أعلى على الصحة العامة في جميع أنحاء العالم.
من وقع اتفاقيات الاعتراف المتبادل مع إدارة الغذاء والدواء؟
حاليا ، لدى إدارة الغذاء والدواء الأمريكية اتفاقيات اعتراف متبادل مع الاتحاد الأوروبي (EU) والمملكة المتحدة (المملكة المتحدة). بالإضافة إلى ذلك ، في 12 يناير 2023 ، وقعت إدارة الغذاء والدواء الأمريكية اتفاقية MRA مع سويسرا. ومع ذلك ، قبل أن تصبح اتفاقية MRA سارية المفعول ، يجب على إدارة الغذاء والدواء تقييم قدرات التفتيش السويسرية للتأكد من أنها تلبي متطلبات الولايات المتحدة. وبالمثل ، يجب على الوكالة السويسرية للمنتجات العلاجية (Swissmedic) تقييم امتثال إدارة الغذاء والدواء للمتطلبات السويسرية.

القيود
وتتعلق تقييمات القدرات حاليا بعمليات التفتيش الروتينية للمراقبة. ومع ذلك ، هناك إمكانية لتضمين أنواع المنتجات والفحص التالية في تغطية الاتفاقية بعد إجراء مزيد من التقييم:
1. لقاحات للاستخدام البشري
2. المستحضرات الصيدلانية المشتقة من البلازما
3. المنتجات البحثية (مواد التجارب السريرية) ، الخاصة بكل اتفاقية
ناقشت إدارة الغذاء والدواء الأمريكية والمملكة المتحدة إمكانية توسيع نطاق MRA ليشمل اللقاحات والمستحضرات الصيدلانية المشتقة من البلازما للاستخدام البشري. وسيعاد النظر في قرار بشأن هذه المسألة في تموز/يوليو 2025 بعد إجراء تقييمات إضافية.
وبالمثل ، استكشفت إدارة الغذاء والدواء والاتحاد الأوروبي أيضا توسيع MRA لتشمل اللقاحات والمستحضرات الصيدلانية المشتقة من البلازما للاستخدام البشري. ستعيد إدارة الغذاء والدواء الأمريكية تقييم هذه المشكلة في يوليو 2025 ، مع الأخذ في الاعتبار النتائج المستخلصة من التقييمات الإضافية.
يستثنى من نطاق MRA: المنتجات الطبية العلاجية المتقدمة (ATMPs) ، والدم البشري ، والبلازما البشرية ، والأنسجة والأعضاء البشرية ، والخلايا (Swissmedic MRA) ، والمناعة البيطرية.
ملاحظة: إذا كنت تريد أن يقوم فريقنا بتخصيص منتج رعاية منزلية جديد ، مع FDA و MDR و ISO و FSC والمزيد ، يرجى الاتصال insights@medasiagroup.com
ونحن نوصي
المنشورات ذات الصلة
- اشترك في MedInsights
- اشترك في MedInsights
- اشترك في MedInsights
- اشترك في MedInsights
- اشترك في MedInsights












