La FDA et l’UE élargissent l’accord de reconnaissance mutuelle, encore une fois!

Le 31 mai 2023, la Food and Drug Administration (FDA) des États-Unis et l’Union européenne (UE) ont annoncé l’élargissement de l’annexe sectorielle de l’Accord de reconnaissance mutuelle (ARM) entre les États-Unis et l’Union européenne pour les bonnes pratiques de fabrication pharmaceutique (BPF). Cette expansion comprend maintenant les inspections des produits pharmaceutiques vétérinaires, également appelés « médicaments pour animaux ».
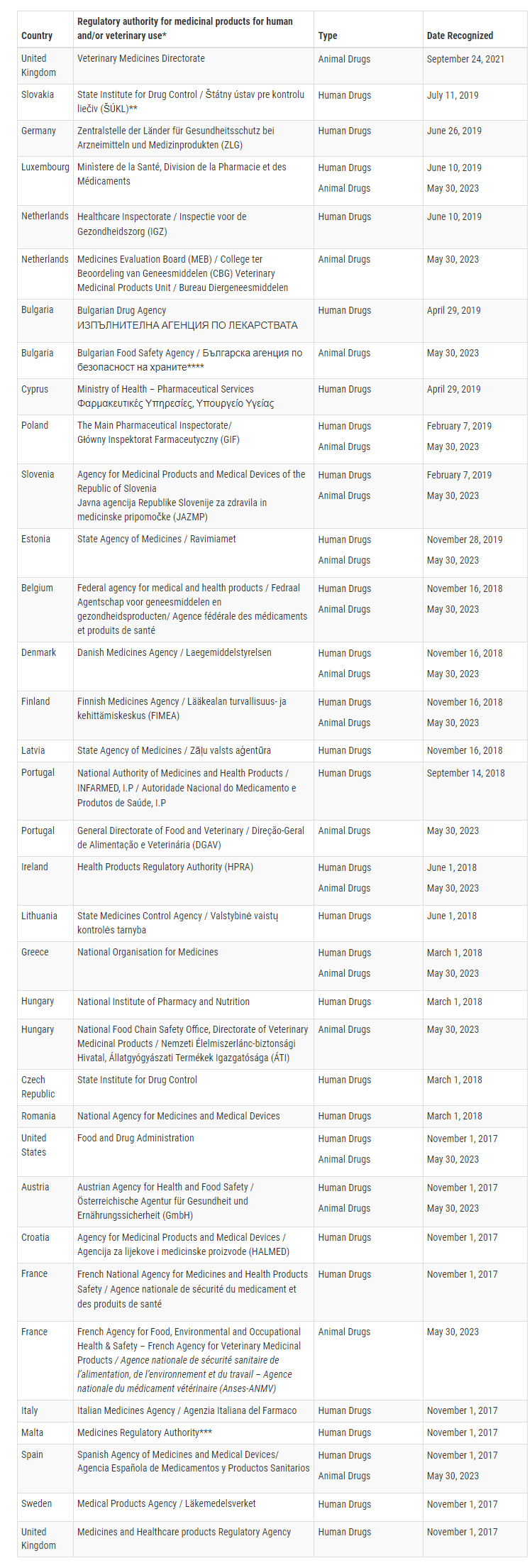
Actuellement, la FDA a confirmé que 16 États membres de l’Union européenne sont capables de mener des inspections BPF pour des produits vétérinaires spécifiques à un niveau équivalent à celui des États-Unis. Ces États membres sont l’Autriche, la Belgique, la Bulgarie, le Danemark, l’Estonie, la Finlande, la France, la Grèce, la Hongrie, l’Irlande, le Luxembourg, les Pays-Bas, la Pologne, le Portugal, la Slovénie et l’Espagne.
Avec cet ARM élargi, la FDA peut s’appuyer sur les inspections BPF menées par ces 16 États membres pour les installations de produits vétérinaires, tandis que l’Union européenne s’appuiera sur les inspections menées par la FDA. Cette reconnaissance mutuelle renforce la coopération réglementaire et rationalise la surveillance des produits pharmaceutiques vétérinaires entre la FDA et l’UE.
Qu’est-ce que le ARM?
Les accords de reconnaissance mutuelle (ARM) facilitent la collaboration entre la FDA et les organismes de réglementation étrangers, ce qui permet aux inspecteurs des médicaments de se fier aux renseignements d’inspection effectués dans leurs territoires respectifs. La Food and Drug Administration Safety and Innovation Act, mise en œuvre en 2012, confère à la FDA le pouvoir d’établir des accords reconnaissant les inspections de médicaments menées par des autorités réglementaires étrangères qui répondent aux exigences américaines.
Les ARM ont deux objectifs principaux :
1. Amélioration de l’efficacité : En évitant les inspections en double, les ARM favorisent des processus simplifiés pour les systèmes de réglementation américains et étrangers.
2. Affectation des ressources : Les ARM permettent de réaffecter les ressources pour se concentrer sur l’inspection des installations de fabrication de médicaments présentant des risques potentiellement plus élevés pour la santé publique dans le monde entier.
Qui a signé des ARM avec la FDA?
À l’heure actuelle, la FDA a conclu des ARM avec l’Union européenne (UE) et le Royaume-Uni. De plus, le 12 janvier 2023, la FDA a signé un ARM avec la Suisse. Toutefois, avant l’entrée en vigueur de cet ARM, la FDA doit évaluer les capacités d’inspection de la Suisse afin de s’assurer qu’elles répondent aux exigences américaines. De même, l’Institut suisse des produits thérapeutiques (Swissmedic) doit évaluer la conformité de la FDA aux exigences suisses.

Limites
Les évaluations de la capacité portent actuellement sur les inspections de surveillance de routine. Toutefois, il est possible que les types de produits et d’inspections suivants soient inclus dans la couverture de l’accord après une évaluation plus approfondie :
1. Vaccins à usage humain
2. Produits pharmaceutiques dérivés du plasma
3. Produits expérimentaux (matériel d’essai clinique), spécifiques à chaque accord
La FDA et le Royaume-Uni ont discuté de la possibilité d’élargir le champ d’application de l’ARM pour inclure les vaccins et les produits pharmaceutiques dérivés du plasma à usage humain. Une décision sur cette question sera réexaminée en juillet 2025 après avoir effectué des évaluations supplémentaires.
De même, la FDA et l’UE ont également envisagé d’élargir l’ARM pour inclure les vaccins et les produits pharmaceutiques dérivés du plasma à usage humain. La FDA réévaluera cette question en juillet 2025, en tenant compte des résultats d’évaluations ultérieures.
Sont exclus du champ d’application de l’ARM les médicaments de thérapie innovante (MTI), le sang humain, le plasma humain, les tissus et organes humains, les cellules (ARM de Swissmedic) et les immunologiques vétérinaires.
PS: Si vous souhaitez que notre équipe personnalise un nouveau produit de soins à domicile, avec FDA, MDR, ISO, FSC et plus, veuillez contacter insights@medasiagroup.com
NOUS RECOMMANDONS
Articles connexes
- Abonnez-vous à MedInsights
- Abonnez-vous à MedInsights
- Abonnez-vous à MedInsights
- Abonnez-vous à MedInsights
- Abonnez-vous à MedInsights












