¡La FDA y la UE amplían el Acuerdo de Reconocimiento Mutuo, otra vez!

El 31 de mayo de 2023, la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) y la Unión Europea (UE) anunciaron la expansión del Anexo Sectorial del Acuerdo de Reconocimiento Mutuo (ARM) entre los Estados Unidos y la UE para las Buenas Prácticas de Fabricación Farmacéutica (GMP). Esta expansión ahora incluye inspecciones de productos farmacéuticos veterinarios, también conocidos como "medicamentos para animales".
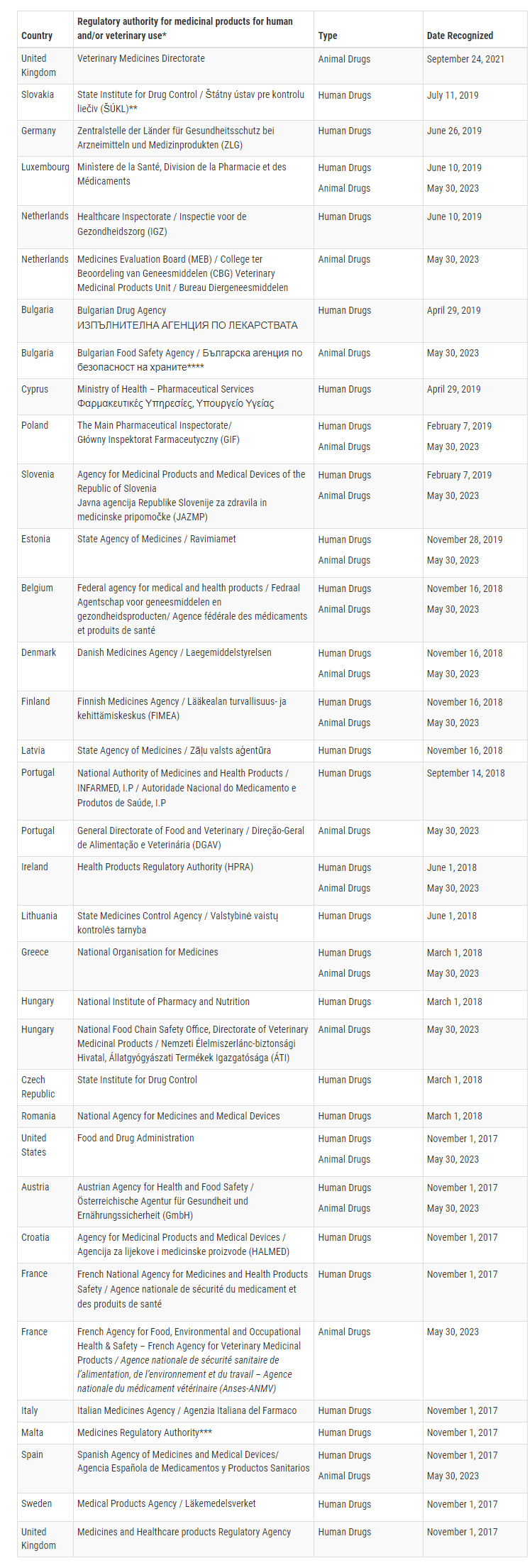
Actualmente, la FDA ha confirmado que 16 Estados miembros de la Unión Europea son capaces de realizar inspecciones GMP para productos veterinarios específicos a un nivel equivalente al de los Estados Unidos. Estos Estados miembros son Austria, Bélgica, Bulgaria, Dinamarca, Eslovenia, España, Estonia, Finlandia, Francia, Grecia, Hungría, Irlanda, Luxemburgo, Países Bajos, Polonia, Portugal y Portugal.
Con este ARM ampliado, la FDA puede confiar en las inspecciones GMP realizadas por estos 16 Estados miembros para las instalaciones de productos veterinarios, mientras que la Unión Europea se basará en las inspecciones realizadas por la FDA. Este reconocimiento mutuo mejora la cooperación reglamentaria y agiliza la supervisión de los productos farmacéuticos veterinarios entre la FDA y la UE.
¿Qué es MRA?
Los acuerdos de reconocimiento mutuo (ARM) facilitan la colaboración entre la FDA y las autoridades reguladoras extranjeras, lo que permite a los inspectores de medicamentos confiar en la información de inspección realizada en las jurisdicciones de cada uno. La Ley de Seguridad e Innovación de la Administración de Alimentos y Medicamentos, implementada en 2012, otorga a la FDA la autoridad para establecer acuerdos que reconozcan las inspecciones de medicamentos realizadas por autoridades reguladoras extranjeras que cumplan con los requisitos de los Estados Unidos.
Los ARM tienen dos propósitos clave:
1. Mejorar la eficiencia: Al evitar inspecciones duplicadas, los ARM promueven procesos simplificados para los sistemas regulatorios estadounidenses y extranjeros.
2. Asignación de recursos: Los ARM permiten la reasignación de recursos para centrarse en la inspección de las instalaciones de fabricación de medicamentos con riesgos potencialmente más altos para la salud pública en todo el mundo.
¿Quién ha firmado ARM con la FDA?
Actualmente, la FDA tiene ARM vigentes con la Unión Europea (UE) y el Reino Unido (UK). Además, el 12 de enero de 2023, la FDA firmó un ARM con Suiza. Sin embargo, antes de que este MRA entre en vigencia, la FDA debe evaluar las capacidades de inspección de Suiza para garantizar que cumplan con los requisitos de los Estados Unidos. Del mismo modo, la Agencia Suiza de Productos Terapéuticos (Swissmedic) debe evaluar el cumplimiento de la FDA con los requisitos suizos.

Limitaciones
Las evaluaciones de la capacidad se refieren actualmente a las inspecciones de vigilancia de rutina. Sin embargo, existe la posibilidad de que los siguientes tipos de productos e inspecciones se incluyan en la cobertura del acuerdo después de una evaluación adicional:
1. Vacunas para uso humano
2. Productos farmacéuticos derivados del plasma
3. Productos en investigación (material de ensayo clínico), específicos para cada acuerdo
La FDA y el Reino Unido han discutido la posibilidad de ampliar el alcance del ARM para incluir vacunas y productos farmacéuticos derivados del plasma para uso humano. Una decisión sobre este asunto se revisará en julio de 2025 después de realizar evaluaciones adicionales.
Del mismo modo, la FDA y la UE también han explorado la expansión del ARM para incluir vacunas y productos farmacéuticos derivados del plasma para uso humano. La FDA volverá a evaluar este problema en julio de 2025, teniendo en cuenta los hallazgos de evaluaciones adicionales.
Se excluyen del alcance del ARM: medicamentos de terapia avanzada (ATMP), sangre humana, plasma humano, tejidos y órganos humanos, células (Swissmedic MRA) e inmunológicos veterinarios.
PD: si desea que nuestro equipo personalice un nuevo producto de atención domiciliaria, con FDA, MDR, ISO, FSC y más, comuníquese con insights@medasiagroup.com
RECOMENDAMOS
Artículos relacionados
- Suscríbase a MedInsights
- Suscríbase a MedInsights
- Suscríbase a MedInsights
- Suscríbase a MedInsights
- Suscríbase a MedInsights












